Кокцидиоз — болезнь, которую провоцируют кокцидии. Попадая в организм, они начинают размножение, превращаясь в пропагативные стадии под названием ооцисты кокцидий. Чаще заболевание наблюдается животных, однако иногда диагностируется и у человека. Кокцидиоз практически не имеет симптомов, а распространение его минимально. Во всем мире известно всего пару сотен случаев заражения человека кокцидиями.

Woman having abdominal pain, upset stomach or menstrual cramps
Эпидемиология
Кокцидиоз у человека возникает из-за возбудителя Isospora belli. Во внешней среде ооцисты паразитов существуют около нескольких месяцев и попадают в организм человека через немытые руки, овощи и фрукты, на которых находятся кокцидии. Isospora hominis поражает крупный рогатый скот, а заражение человека наблюдается в случаях употребления мяса животного, которое поддалось плохой температурной обработке.
Строение паразита
Кокцидии паразитируют в слизистой оболочке тонкого кишечника.
Взрослые кокцидии имеют чаще всего круглую форму, реже — овальную, и довольно сложное строение. С наружного бока паразит имеет многослойную подстилку мембранных пузырьков, под которыми располагается трубчато-фибриллярная система, формирующая с оболочками остов зоита. Внешне оболочка кокцидии представляет собой целостную поверхностность, а слои состоят из задних и передних прерываний (опорных колец). На переднем кольце расположен коноид, имеющий стенки в форме свернутых фибрилл. Коноид играет роль опоры, которая помогает паразиту удерживаться в ходе того, как зоит оказывается внутри клетки хозяина.
Начало зоита представляет собой трубчатые структуры, которые имеют на внутренней стороне небольшие расширения, называемые роптрии. Расширения исполняют функцию вывода специального вещества, помогающего кокцидии легче пробираться в клетку хозяина. В цитоплазматическом слое паразита присутствуют и другие элементы, имеющиеся у остальных клеток, такие как митохондрии и эндоплазма. Зоит содержит и жировые, углеводные и белковые составляющие в виде резерва паразита.
Жизненный цикл развития
Цикл развития паразита берет начало после того, как кокцидия попадает в кишечный тракт хозяина. Сначала в кишечной полости образуется спорозоит, выходящий из ооцисты, поглощенной хозяином. Спорозоит — маленькая клетка, имеющая ядро и круглую форму. Он быстро оказывается в эпителиальных клетках желудочно-кишечного тракта, где активно развивается и увеличивается в размерах. Этот этап в развитии паразита именуется шизонт.
Затем шизонт продолжает развитие и получает ядра, количество которых варьируется от 8-ми до 16-ти. Постепенно увеличивающийся в размерах шизонт передвигается подэпителиальный слой, где его развитие оканчивается размножением, имеющим бесполый путь. Шизонт распадается на множество клеточных структур, имеющих 1 ядро и форму веретена. Цикл размножения длится около 4-х дней, после чего клетки приобретают название мерозоиты.
При испражнении зараженной человек выделяет незрелые ооцисты.
Мерозоиты опять попадают в кишечник, где их развития продолжается. Занимает размножение на несколько суток больше времени. Мероизоты, у которых нет возможности сформировать новые шизонты, зарождают половые структуры с женскими и мужскими макрогаметами. Затем проходит процесс оплодотворения, в котором принимают участие макрогаметы и микрогаметы, образуя зиготу. Получившаяся зигота имеет двухслойную оболочку и называется «ооциста». На этом жизненный цикл развития паразита внутри хозяина прекращается, поскольку ооцисте для жизни нужен кислород, из-за чего она покидает желудочно-кишечный тракт владельца.
Что такое кокцидиоз и чем он опасен для человека
Кокцидиоз — болезнь, вызываемая присутствием в тонком кишечнике человека кокцидий. Цикл развития кокцидий комбинирует бесполое и половое размножение. В результате образуются ооцисты — пропагативная стадия кокцидий, которые вместе с фекалиями выделяются в окружающую среду.
Isospora belli паразитируют исключительно в организме человека и весь цикл их размножения происходит в одном организме. Инкубационный период занимает от шести до восьми дней.
После деления ооцисты образуется около восьми спорозоитов, которые нарушают работу кишечника, разрушая клетки эпителия тонкого кишечника и провоцируют возникновение воспаления. Воспаление в свою очередь в тяжелых случаях приводит к возникновению язв и эрозий, которые требуют более сложного и длительного лечения.
Симптомы заражения человека кокцидиями
Кокцидиоз не вызывает ярко выраженной симптоматики у человека.
Человек, имеющий кокцидиоз, продолжительное время может не подозревать о том, что болен, поскольку заболевание практически не имеет симптомов, долгий промежуток времени не дает о себе знать, а в медицине не было зафиксировано случаев смерти от кокцидиоза. Диагностировать болезнь возможно только в ситуациях, когда ооцисты были найдены в каловых массах человека.
При заражении кокцидиями Isospora belli больные испытывают следующие симптомы:
- отсутствие аппетита;
- болевые ощущения в желудочно-кишечном тракте;
- недомогание;
- тошноту.
После проявления вышеописанной симптоматики признаки постепенно начинают ослабевать, а излечение происходит приблизительно спустя месяц. Впрочем, существуют единичные случаи, когда заражение кокцидиями уже на начальной стадии начинало протекать в тяжелой форме, а симптомы выражались в виде повышенной температуры тела, диареи с примесями крови со слизью и мощным отравлением организма.
В случаях заражения возбудителем Isospora hominis человек испытывает более облегченную симптоматику, а расстройство стула гораздо менее ярко выражено. Однако и в этом случае нельзя пускать болезнь на самотек, важно периодически посещать специалиста и следовать всем рекомендациям по приему лекарственных препаратов для скорейшего выздоровления.
Кокцидии у животных: у кроликов, кошек, собак и домашних птиц
Кокцидиозы – это серьезные заболевания домашних животных, причиняющие существенный экономический ущерб таким отраслям как скотоводство, птицеводство и кролиководство, прежде всего, из-за падежа молодняка и из-за снижения массы тела у больных животных и птицы (у кур наблюдается снижение яйценоскости).
Если для человека опасны только две разновидности кокцидии, то для животных – более десяти. Этот паразит широко распространен в природе, кроме того, источником заражения служат корм и вода, в которых содержатся ооцисты кокцидии, а также больные животные, которые выделяют ооцисты с калом и/или рвотными массами.


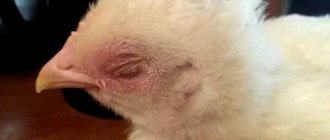
Курица, заболевшая кокцидиозом
У взрослых животных заболевание может протекать бессимптомно, но они заражают молодняк, половина которого погибает даже при оказании помощи (у кроликов падеж может достигать 60-85%).
Животные, заболевшие кокцидиозом, погибают через 7-10 дней. За этот период простейшие, внедрившиеся в клетки их желудка и кишечника, успевают разрушить слизистую оболочку, создавая тем самым условия для бурного размножения микроорганизмов.
Из-за нарушения пищеварения у животных возникает диарея со слизью и кровью, вздутие кишечника с выделением зловонных газов, нередко рвота. Из-за обезвоживания возрастает вязкость крови и, как следствие, нагрузка на сердце. Животные отказываются от пищи и в итоге погибают от истощения и/или обезвоживания.
По мнению ветеринаров, кокцидиями заражено около трети всех животных в мире, но у них он протекает бессимптомно, без явной клинической картины. Это относится и к таким домашним животным как кошки и собаки.
Но если у животного снизился иммунитет, если оно недавно переболело, то может развиться острая форма кокцидиоза. К наиболее угрожаемой группе относятся также старые коты и котята.
Симптомы примерно такие же, как и у сельскохозяйственных животных, хотя инкубационный период дольше – 1-2 недели, а в целом продолжается до 3 недель. Иногда заболевание протекает в легкой форме и заканчивается само собой, но если оно переходит в тяжелую форму, то может принять хронический характер. Особо опасен кокцидиоз для котят, так как обезвоживание может привести к летальному исходу.
Диагностика
Исследование каловых масс установит вид кокцидий.
Специалисты могут диагностировать кокцидиоз только после того, как у человека будет взят фекальный мазок. Зачастую ооцисты выводятся в процессе выздоровления больного. В случаях же, когда в естественном мазке, который не подвергался окрасе, ооцисты не были обнаружены, доктора прибегают к флотационным способам обогащения каловых масс. 5 грамм фекалий распределяют стеклянной палочкой по дну емкости, после чего орошают их раствором калия, который не допускает развитие банальной микрофлоры. После этого емкости с фекалиями оставляют на определенное время при комнатной температуре, дожидаясь, пока в них проявятся ооцисты, развивающиеся в спороцисты и спорозоиты. Благодаря этому лаборанты устанавливают вид кокцидий.
Копропротозооскопия (исследование фекалий на кишечные простейшие)
Метод нативного мазка с физраствором и раствором Люголя
Необходимые реактивы и оборудование 1. Физиологический раствор 2. Раствор Люголя 1 %-ный 3. Буферный раствор метиленового синего 4. Уксусно-кислый спиртовой раствор йода 5. Предметные и покровные стекла 6. Деревянные палочки 7. Стеклянные пипетки 8. Стерильная стеклянная или пластиковая посуда (для забора фекалий) 9. Микроскоп Подготовка к работе Для исследования выбирают в первую очередь неоформленные фекалии, участки слизи или прожилки крови в кале. Фекалии исследуют теплыми, т.е. не позднее 15 — 20 мин после дефекации, когда возможно обнаружение подвижных вегетативных форм (трофозоитов) простейших (время можно увеличить до 45 мин и до 1 ч, если фекалии сохранялись это время в холодильнике при температуре 4 — 5 °С). Физиологический раствор подогреть до 36 — 37 °С. Приготовление маточного 5 %-ного раствора Люголя: 10 г иодида калия растворить в 30 мл дистиллированной воды + 5 г кристаллического йода, размешать до полного растворения и долить до 100 мл дистиллированной водой. Хранить после приготовления в склянке из темного стекла. Приготовление рабочего 1 %-ного раствора Люголя: 5 мл маточного 5 %-ного раствора Люголя соединить с 20 мл физиологического раствора, хорошо перемешать. Хранить в склянке из темного стекла не более 14 дней. Приготовление буферного метиленового синего: 50 мл дистиллированной воды + 46,3 мл раствора уксусной кислоты (1,2 мл ледяной уксусной кислоты + 98,8 мл дистиллированной воды) + 3,7 мл раствора уксуснокислого натрия (1,6 г уксуснокислого натрия + 100 мл дистиллированной воды) + 0,5 г метиленового синего. Приготовленный раствор хорошо перемешивается, настаивается 15 мин и фильтруется. Приготовление уксусно-кислого спиртового раствора йода: 10 мл спиртового раствора Люголя (40 мл 70 %-ного этилового спирта + несколько кристаллов йода, хорошо перемешать, раствор должен иметь цвет «крепкого чая») + 10 мл 25 %-ного раствора уксусной кислоты. Ход исследования — Нанести на предметное стекло 1 каплю изотонического теплого (36 — 37 °С) раствора в левой половине и 1 каплю 1 %-ного раствора Люголя в правой половине предметного стекла. — Выбрать из пробы фекалий деревянной палочкой патологические примеси или немного фекалий (с булавочную головку) и перенести в каплю физраствора и растереть до получения равномерной негустой эмульсии, а затем поместить в каплю с Люголем и также растереть. — Накрыть капли покровным стеклом (через правильно приготовленный мазок можно видеть газетный шрифт). — Микроскопировать при увеличении: сначала — объектив ×8 или ×10, окуляр ×10, затем объектив ×40, в т.ч. для дифференциальной диагностики амеб и жгутиковых, включая лямблии и диэнтамебу. Примечания. 1. Для дифференциальной диагностики трофозоитов дизентерийной амебы с непатогенными амебами необходимо приготовить препарат с буферным раствором метиленового синего: нанести на предметное стекло большую каплю буферного раствора метиленового синего, в нее внести деревянной палочкой небольшое количество слизи, фекалий с прожилками крови, накрыть покровным стеклом, дать постоять 5 — 10 мин, чтобы краска проникла в трофозоиты, и сразу микроскопировать для исключения перекрашивания трофозоитов. Результат окрашивания: трофозоиты амеб окрашиваются в разные оттенки синего — ядро синее, цитоплазма голубая, эритроциты синие. Цисты амеб, трофозоиты, цисты жгутиковых и ооцисты кокцидий не окрашиваются. 2. Для выявления ооцист кокцидий: при выполнении вышеописанной методики приготовления нативного мазка с физраствором и 1 %-ным раствором Люголя, в одну из капель вместо 1 %-ного р-ра Люголя вносится капля уксусно-кислого спиртового раствора йода. Палочкой внести небольшое количество фекалий, растереть, накрыть покровным стеклом; микроскопировать при тех же увеличениях. Ооцисты изоспоры выявляются, благодаря хорошей окраске ядер. Эффективность метода — Позволяет выявлять вегетативные формы патогенных простейших и комменсалов, анализировать тип их движения (что имеет важное значение при видовой идентификации простейших, особенно жгутиковых). — Диагностика амебиаза эффективна только при строгом соблюдении стерильного забора фекалий и микроскопического исследования не позднее 15 — 20 мин после дефекации. — Позволяет определять видовые признаки цист амеб и жгутиковых, ооцист кокцидий, благодаря эффективной окраске йодом ядер, жгутикового аппарата, гликогена. Применение метода — Применяется для диагностики кишечных протозоозов: лямблиоза, балантидиаза, амебиаза, кокцидиоза (изоспороза). — Для исследования на кишечные простейшие, в т.ч. на лямблии используются также методы: формалин-эфирного (уксусно-эфирного) осаждения и исследование дуоденального содержимого (см. описание методик в п. 4.2.1.2, 4.2.1.3, 5.1). Примечание. В нативных препаратах с физиологическим раствором при интенсивной инвазии также можно обнаружить яйца гельминтов и личинки стронгилоидеса.
Комплексный метод исследования фекалий на кишечные простейшие и гельминты из консерванта
Универсальный метод диагностики кишечных паразитозов, вызываемых простейшими (амебы, жгутиковые, в т.ч. диентамеба, балантидии и кокцидий) и гельминтами (нематоды, трематоды и цестоды). В основе метода лежит «диагностическая система» КТ-ФЭО-МЦН: консервант Турдыева, формалин-эфирное обогащение, модифицированный метод окраски Циля-Нильсена. Принцип метода: отбор проб фекалий производят в консервант Турдыева (п. 2.1.1), где паразиты фиксируются, и морфологические признаки простейших, яиц и личинок гельминтов сохраняются неизменными длительное время, это обеспечивает дальнейшее исследование материала из единой пробы: — методом влажного мазка из консерванта; — методом мазка из осадка после эфир-формалинового обогащения консервированного материала; — модифицированным методом окрашивания по Цилю-Нильсену мазка из осадка после обогащения материала из консерванта. Эффективность комплексного метода — Выявляет весь спектр кишечных паразитов, в т.ч. редко диагностируемых простейших (диэнтамеба, изоспора), яиц и личинок гельминтов, не требующих специальных методов исследования (например, культивирования и т.п.) включая возбудителей оппортунистических инвазий (кокцидий, стронгилоидес). — Повышается выявляемость сочетанных инвазий. Условия отбора материала: максимально быстро после дефекации с помощью деревянной палочки фекалии переносят в стерильный флакон с консервантом Турдыева (п. 2.1.1), если фекалии оформленные, то количество должно быть в объеме с лесной орех, если жидкие — объемом с чайную (столовую) ложку. Соблюдая соотношение: 3 части консерванта и 1 часть фекалий. Флакон закрывают крышкой, предварительно тщательно размешав фекалии деревянной палочкой до гомогенной суспензии.
Метод влажного мазка из консерванта
Необходимое оборудование и реактивы 1. Консервант Турдыева 2. Раствор Люголя 1 %-ный 3. Предметные и покровные стекла 4. Деревянные палочки 5. Микроскоп Ход исследования — На предметном стекле готовятся два препарата: пипеткой из консерванта с фекалиями, очень осторожно, не взбалтывая содержимое флакона, нанести две капли придонного осадка (в правой и левой части стекла). — Растереть деревянной палочкой. — В одну из капель добавить каплю раствора Люголя 1 %-ного. — Каждую каплю накрывают покровным стеклом (покровные стекла можно окантовать вазелином для предотвращения высыхания и смещения покровного стекла). — Микроскопируют при увеличении: объектив ×8 или ×10, окуляр ×7 или ×10, затем объектив ×40 (в отдельных случаях, например для криптоспоридий, применяют увеличение объектива ×90 или ×100 и микроскопируют с масляной иммерсией). Эффективность метода — Эффективен для выявления цист и трофозоитов простейших, включая редко выявляемую диентамебу, а также яиц и личинок гельминтов. Применение метода — Для диагностики кишечных протозоозов. Примечание. Ооцисты при достаточном количестве обнаруживаются в верхнем слое мазка непосредственно под покровным стеклом по эффекту негативного окрашивания раствором Люголя.
Метод исследования материала из консерванта формалин-эфирным обогащением
Необходимое оборудование и реактивы 1. Физиологический раствор 2. Раствор Люголя 1 %-ный 3. Этиловый эфир 4. Раствор формалина 10 %-ный нейтральный (для нейтрализации — во флакон темного стекла с раствором формалина на дно слоем в 1 — 2 см насыпать порошкообразный углекислый кальций) 5. Палочки деревянные 6. Центрифужные градуированные пробирки 7. Воронки стеклянные 8. Бинт (марля) 9. Стекла предметные и покровные 10. Пипетки стеклянные 11. Пробки резиновые 12. Центрифуга 13. Микроскоп Ход исследования — Перенести пипеткой в центрифужную пробирку осадок фекалий со дна флакона с консервантом в объеме 1,5 — 2 мл. — Добавить 6 — 7 мл 10 %-ного нейтрального формалина. — Закрыть пробирку резиновой пробкой и тщательно перемешать, энергично встряхивая пробирку в течение 5 с. — Полученную взвесь перелить в другую центрифужную пробирку через стеклянную воронку с двухслойным бинтом (марлей). — Добавить 2 — 3 мл этилового эфира. — Закрыть пробирку пробкой и энергично встряхивать в течение 30 с. — Убрать пробку и дать постоять пробирке в течение 2 мин в вытяжном шкафу. — Затем центрифугировать 2 мин при 1500 об/мин или 1 — 1,5 мин при 3000 об/мин. — Отделить палочкой образовавшуюся «каловую пробку» от стенок пробирки. — Перевернуть пробирку дном вверх и вылить содержимое (можно ватным тампоном обтереть стенки пробирки, чтобы жидкость не стекала на дно и не увеличивала объем осадка), пробирку поставить в штатив. — На предметное стекло по обе стороны от центра нанести по капле физиологического раствора и раствора Люголя. — Перенести в каждую каплю осадок из центрифужной пробирки, размешать деревянной палочкой и накрыть каждую каплю покровным стеклом. — Микроскопировать при увеличении: объектив ×8 или ×10, окуляр ×7 или ×10, затем с объективом ×40 (при необходимости использовать окуляр ×90 или ×100 с масляной иммерсией). Применение метода — Для диагностики цист кишечных простейших и яиц гельминтов.
Модифицированный метод окрашивания по Цилю-Нильсену мазков из осадка после обогащения консервированного материала
Необходимые реактивы и оборудование 1. Смесь Никифорова 2. Серная кислота 10 %-ная 3. Фуксин основной 4. Фенол 5. Палочки деревянные 6. Предметные стекла 7. Химические стаканчики или «мостики» для окрашивания мазков 8. Стеклянные пипетки 9. Кюветы эмалированные 10. Микроскоп Ход исследования — На предметное стекло нанести пипеткой каплю осадка из центрифужной пробирки после обогащения (п. 4.2.4.2.2) и круговым движением палочки приготовить мазок (можно добавить каплю физиологического раствора, чтобы мазок не был густым). — Высушить на воздухе (тщательно). — Фиксировать мазок в смеси Никифорова в течение 20 — 30 мин. — После фиксации мазок высушить на воздухе. — Окрашивать мазок в растворе карболового фуксина (приготовление в п. 4.2.4.4), поместив мазок в химический стаканчик с этой краской на 45 мин! — Промыть мазок проточной водой. — Обесцветить мазок в 10 %-ном растворе серной кислоты до прекращения отхождения розовых «облачков» красителя. Промыть тщательно проточной водой. — Подкрасить мазок 5 %-ным раствором малахитового зеленого, приготовленного на 10 %-ном этиловом спирте в течение 2 — 5 мин. — Промыть мазок в воде. — Высушить мазок на воздухе. — Микроскопировать при увеличении: окуляр ×10, объектив ×90 или ×100 с масляной иммерсией. Применение метода — Для выявления ооцист кокцидий, включая криптоспоридии и изоспоры. Эффективность — Предварительная фиксация в консерванте и обогащение осаждением повышает выявляемость ооцист по сравнению со стандартной методикой диагностики ооцист кокцидий, включая криптоспоридии и изоспоры.
Метод Бермана в модификации для исследования на балантидиаз
Необходимые реактивы и оборудование 1. Дистиллированная вода 2. Химические стаканчики 3. Палочки деревянные 4. Чашки Петри 5. Пробирки центрифужные 6. Центрифуга 7. Микроскоп Ход исследования — В химический стаканчик или в чашку Петри положить порцию фекалий 10 — 15 г (величиной с орех), предварительно перемешав фекалии. — Залить теплой (45 °С) дистиллированной водой, чтобы фекалии были полностью покрыты. — Через 1,5 — 2 ч слить жидкость в центрифужные пробирки. — Центрифугировать 2 мин при 1500 об/мин. — Надосадочную жидкость слить, осадок с помощью стелянной пипетки перенести на предметное стекло (по 2 капли на каждое стекло), накрыть покровными стеклами. — Микроскопировать при увеличении: объектив ×10, окуляр ×10; для уточнения морфологических особенностей: объектив ×40; окуляр ×10. Эффективность метода — Позволяет выявлять трофозоиты балантидий при низкой интенсивности инвазии. Применение метода — Для диагностики балантидиаза.
Методы окрашенных мазков на криптоспоридиоз
(по Цилю-Нильсену; Романовскому-Гимзе) Необходимые реактивы и оборудование 1. Реактивы: фуксин основной, этиловый спирт, фенол, раствор серной кислоты 7 %-ный (5 — 10 %-ный), раствор малахитовой зелени 5 %-ный в 10 %-ном этиловом спирте, водный раствор метиленового синего 0,2 %-ный, раствор малахитового зеленого 5 %-ный, азур-эозин по Романовскому-Гимзе 10 %-ный раствор, флотационные растворы 2. Предметные стекла 3. Стеклянные или деревянные палочки 4. Горелка (спиртовка) 5. Кюветы эмалированные 6. Мостики стеклянные или «контейнеры» для окраски мазков 7. Пипетки, стеклянные капилляры 8. Груши резиновые 9. Химические стаканчики 10. Центрифужные пробирки объемом 15 мл 11. Металлические петли 12. Центрифуга 13. Микроскоп Подготовка к работе Приготовление рабочего раствора краски по Цилю-Нильсену — Фуксина основного 2 г растворить в 12 мл спирта 96°-ного. — Фенола 5 г растворить в 50 мл дистиллированной воды. — Слить вместе растворы фуксина и фенола, долить дистиллированной воды до 100 мл, перемешать. Подготовка материала для исследования Из фекалий приготовить мазок одним из следующих способов. А) Нативный мазок — Нанести на предметное стекло небольшое количество фекалий — Растереть фекалии тонким слоем (при необходимости к комочку фекалий добавляют 1 — 2 капли физиологического раствора или воды) — Тщательно высушить мазок на воздухе (не менее 30 мин) Б) Обогащение флотационным методом — Приготовить флотационный раствор (в качестве флотационного раствора использовать насыщенный раствор хлористого натрия или насыщенный раствор сульфата цинка — 331 г сульфата цинка на 1 л водопроводной воды) — Разбавить фекалии водой, размешать — Процедить разбавленные фекалии через 2-слойный бинт в центрифужную пробирку — Центрифугировать при 1500 об/мин в течение 3 — 4 мин — Удалить супернатант (объем оставшегося осадка не должен превышать 1 мл) — Добавить флотационную жидкость до половины объема пробирки — Размешать содержимое пробирки стеклянной палочкой — Добавить флотационную жидкость до верхнего края пробирки — Центрифугировать при 1500 об/мин в течение 3 — 4 мин Собрать поверхностную пленку металлической петлей или стеклянным капилляром и поместить на предметное стекло В) Обогащение методом седиментации — Поместить в пробирку 0,5 — 1 г фекалий — Залить 10 — 12 мл изотонического раствора хлорида натрия — Перемешать содержимое пробирки до образования однородной суспензии — Процедить суспензию через двойной слой марли в другую пробирку — Центрифугировать — Слить надосадочную жидкость — Повторно залить осадок изотоническим раствором хлорида натрия — Центрифугировать — Слить надосадочную жидкость — Перенести осадок пипеткой на предметное стекло — Приготовить из осадка мазок Ход исследования Высушить мазки на воздухе (мазки, приготовленные одним из способов, описанных в п.п. , , ). — Фиксировать мазки в смеси Никифорова в течение 10 — 15 мин. — Высушить на воздухе. — Фиксированные и высушенные мазки быстро провести 3 — 5 раз над пламенем горелки. — Поместить мазок в рабочий раствор карбол-фуксина на 5 — 10 мин. — Промыть мазок водопроводной водой. — Обесцветить мазок 7 %-ным раствором серной кислоты в течение 20 — 60 с. — Промыть в воде. — Подкрасить в течение 5 мин 5 %-ным раствором малахитовой зелени. — Промыть в воде. — Высушить на воздухе. — Микроскопировать при увеличении: окуляр ×10, объектив ×90 или ×100 с масляной иммерсией. Эффективность метода — Метод окраски фиксированных мазков по Цилю-Нильсену считается одним из наиболее надежных для выявления ооцист криптоспоридий. Результат: ооцисты криптоспоридий окрашиваются в разные оттенки ярко-красного цвета и имеют вид округлых образований диаметром около 5 мкм. Оболочка ооцист окрашивается фуксином неравномерно. Сопутствующая микрофлора окрашивается в зеленые цвета. Применение метода — Применяется для диагностики криптоспоридиоза. Примечание. Для окрашивания фиксированных мазков можно применять и другие красители, например: Азур-эозином по Романовскому-Гимзе окрашивать от 10 до 30 — 45 мин в 10 %-ном растворе красителя при этом ооцисты не окрашиваются или слабо окрашиваются и имеют вид округлых образований, внутри ооцист (по периферии) могут быть в виде бледно-голубых удлиненных и слегка изогнутых телец (спорозоиты) с красноватыми гранулами внутри.
Лечение заболевания
Методика терапии кокцидиоза в настоящий момент не была до конца разработана, поскольку болезнь встречается довольно редко. Диагностируются единицы заразившихся в течение десятков лет. При кокцидиозе легкой и средней формы чаще специалисты назначают общеукрепляющую и симптоматическую терапию, в которую входит прием витаминных комплексов. Прописывают пациентам употребление «Нитрат висмута основной» 3 раза в сутки по 1-у грамму. Если же у больного наблюдается тяжелая или затяжная форма заболевания, доктора назначают «Пириметамин» и «Сульфазин». Животным же зачастую дают лекарственный препарат «Трихопол».
Распространение
Изоспороз у собак, как уже упоминалось, является широко распространенной патологией (от 10 до 60% животных в разных регионах). Заражение происходит при попадании возбудителя в рот здоровой особи (алиментарно).
Источниками заражения являются:
- Кал больных животных (особенно при копрофаги, что часто наблюдается при нарушении обмена веществ).
- Загрязненные предметы ухода (миски, игрушки и так далее).
- Вода, содержащая споры возбудителя.
- Загрязненные корма.
- Шерсть (при облизывании) и загрязненные соски кормящих сук (щенки заражаются при кормлении матерью).
Наиболее восприимчивы щенки, начиная с двухнедельного возраста и до шести месяцев. Взрослые собаки болеют редко, чаще всего являясь носителями. Но при возникновении определенных условий, носительство может перейти в активную форму болезни, и наоборот – щенок, находящийся в хорошем состоянии (упитанность, правильное кормление, хороший иммунитет), может не заболеть даже при заражении.
Споры кокцидий очень устойчивы ко многим внешним воздействиям и дезинфектантам. Быстрее всего (за 7 – 10 секунд) они погибают под действием высоких температур (от 80 до 100 градусов).
Насекомые (мухи), грызуны (мыши, крысы) и птицы могут являться механическими переносчиками возбудителя.
Профилактика
Врачи сходятся во мнении — чтобы оградить себя от поражения кокцидиями, человеку достаточно соблюдать санитарно-гигиенические нормы. Они включают в себя мытье рук после опорожнения, мытье овощей и фруктов и употребление в еду мясных продуктов, которые подверглись достаточной температурной обработке. Питание должно быть здоровым и сбалансированным, а питьевой режим должен включать в себя исключительно чистую и питьевую воду. Важно поддерживать порядок и чистоту в помещениях, в которых находится человек и животные. Специалисты заявляют, что кокцидии не передаются от животных человеку, но следует четко соблюдать правила гигиены по содержанию животных.